Propositions de l’AFT-Technoprog en matière de données génomiques et autres données de santé
Le début du XXIᵉ siècle a vu se rejoindre trois dynamiques majeures : l’explosion du numérique, l’essor de la génomique et la montée d’une médecine fondée sur la donnée.
Publié le 24 décembre 2025, par dans « __Longévité radicale »
Avertissement: les propositions elles-mêmes sont en partie 3
Partie 1 Applications actuelles des données génomiques
Partie 2 Les thérapies potentielles issues de la génomique/transcriptomique
Partie 3 Propositions de modifications législatives
1) Applications actuelles des données génomiques
Le début du XXIᵉ siècle a vu se rejoindre trois dynamiques majeures : l’explosion du numérique, l’essor de la génomique et la montée d’une médecine fondée sur la donnée. Ces transformations changent profondément notre compréhension de la physiologie de l’individu et du vieillissement et pourraient représenter l’opportunité de mieux comprendre le corps humain, d’agir sur sa condition biologique et, à terme, de prolonger la durée de vie humaine en bonne santé.
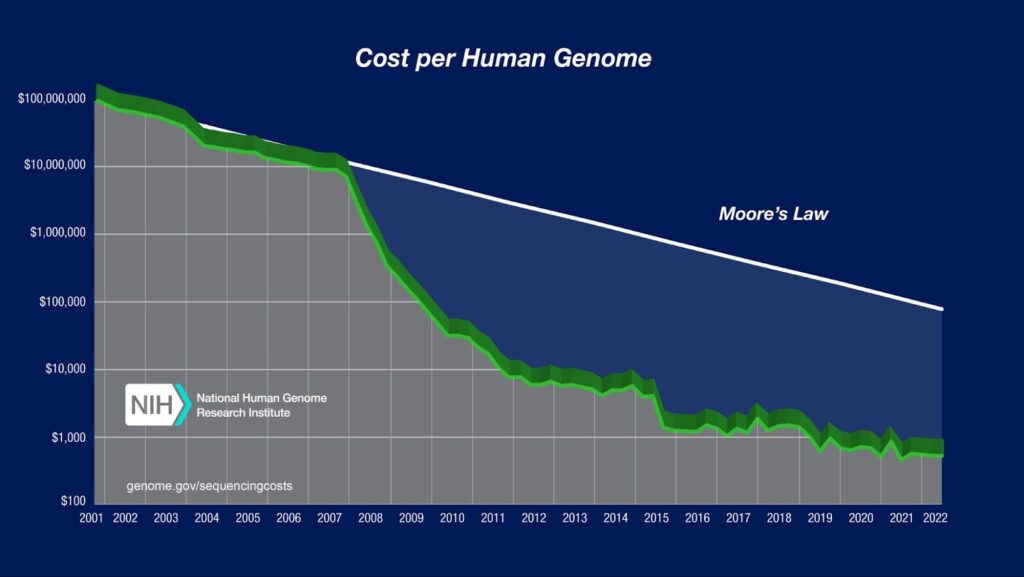
La génomique est au cœur de cette mutation. Depuis le premier séquençage (presque) complet du génome humain au début des années 2000 (un projet qui avait nécessité près de 13 ans de travail et coûté environ 2,7 milliards de dollars) les technologies de séquençage ont connu une révolution spectaculaire. Les méthodes actuelles de séquençage à haut débit, autrefois réservées aux laboratoires spécialisés, sont devenues extrêmement rapides, accessibles et bon marché : séquencer un génome complet coûte aujourd’hui moins de 1 000 dollars, et peut être réalisé en moins de 24 heures. Depuis 2015, même si le coût du séquençage n’a pas diminué de façon aussi marquée, les technologies de séquençage à haut débit (NGS) ont progressé en fiabilité, avec une baisse significative des taux d’erreurs et une meilleure précision des lectures.
Les données génomiques représentent aujourd’hui l’un des outils les plus prometteurs pour transformer la médecine et améliorer la longévité humaine. Leur potentiel repose sur la combinaison de deux dynamiques : d’une part, la capacité technique à séquencer et analyser le génome de millions d’individus avec une grande précision ; d’autre part, l’utilisation d’outils d’intelligence artificielle (comme des modèles d’apprentissage automatique et profond) capables d’identifier des motifs, des corrélations complexes et de générer des prédictions à partir de ces vastes ensembles de données. Cela pourrait permettre une médecine plus préventive, plus personnalisée et, potentiellement, capable d’agir sur les mécanismes fondamentaux du vieillissement. Les scores de risque polygénique (PRS), par exemple, combinent des milliers de variations génétiques pour estimer la prédisposition d’un individu à des maladies comme :
– les cancers du sein, de la prostate ou du côlon ;
– les maladies cardiovasculaires ;
– la maladie d’Alzheimer ;
– le diabète de type 2 ;
– certaines maladies auto-immunes.
Ces évaluations ne sont pas des prédictions déterministes, mais elles offrent une information précieuse pour ajuster la prévention, changer des comportements ou adapter des suivis médicaux beaucoup plus tôt.
Dans le cadre du vieillissement, les recherches actuelles explorent de nombreuses pistes, commeles variants génétiques associés à la longévité exceptionnelle observés chez les centenaires, les gènes impliqués dans la réparation de l’ADN dont l’activité décroît avec l’âge, les réseaux de régulation épigénétiques qui refléterait l’âge biologique plus précisément que l’âge chronologique, ou encoreles gènes liés à la sénescence cellulaire, responsables de l’accumulation de cellules dysfonctionnelles. Il faut savoir que les différences de longévité maximale peuvent être élevées entre espèces biologiquement proches. Par exemple, les salamandres blanches cavernicoles peuvent vivre plus de cent ans, tandis qu’une autre espèce, la necture tachetée, n’atteint qu’environ 34 ans. Ceci signifie que des modifications génétiques relativement spécifiques pourraient permettre des gains de longévité importants
2) Les thérapies potentielles issues de la génomique/transcriptomique
Les données génétiques ne servent donc pas seulement à prédire : elles permettent d’imaginer des interventions actives sur les causes du vieillissement. Parmi les pistes actuellement explorées:
a) Thérapies géniques et édition du génome
Les technologies comme CRISPR ouvrent la possibilité de corriger certaines mutations, d’augmenter l’activité de certains gènes (comme ceux liés à la réparation de l’ADN) ou d’inactiver des gènes qui accélèrent le vieillissement. Dans des études récentes, cette méthode a été utilisée par exemple pour supprimer l’expression de gènes qui favorisent les maladies cardiovasculaires ou modifier les macrophages pour améliorer le nettoyage cellulaire.
b) Médecine épigénétique
Les horloges épigénétiques, dérivées de grandes bases de données génomiques, ouvrent la voie à des interventions qui visent à rétablir un état “plus jeune” de l’expression génétique. Les recherches portent sur :
– la reprogrammation partielle cellulaire ;
– les modulateurs d’enzymes épigénétiques ;
– les interventions combinant génomique et données environnementales.
c) Thérapies combinées et médecine de longévité personnalisée
En croisant génome, métabolisme, microbiote et habitudes de vie, on peut imaginer :
– des protocoles de prévention individualisés ;
– des stratégies combinant compléments ciblés, médicaments, hormones, nutrition optimisée ;
– des interventions précoces sur les voies biochimiques qui régulent le vieillissement (mTOR, IGF-1, sirtuines, NAD+, etc.).
3) Propositions de modifications législatives
Pour les sciences de la santé, nous sommes à un tournant important : la génomique peut devenir une clé essentielle pour développer des thérapies visant à prolonger la durée de vie en bonne santé. Pourtant, la France est aujourd’hui l’un des pays les plus restrictifs en matière d’accès citoyen aux données génétiques. L’interdiction de réaliser des tests génétiques sans prescription médicale limite considérablement la capacité des individus à comprendre leur propre patrimoine biologique, à participer à des programmes de recherche ou à contribuer volontairement à des bases de données scientifiques.
Le partage volontaire de données génétiques et biomédicales pourrait devenir un moteur de la médecine. Dans des pays qui l’autorisent, comme l’Estonie, le Royaume-Uni ou les États-Unis, il a déjà permis des avancées significatives sur les maladies complexes, l’identification de biomarqueurs du vieillissement et l’émergence de thérapies ciblées. Il sert d’ailleurs aussi à d’autres buts, y compris en France: déterminer l’identité de personnes disparues, innocenter des personnes accusées à tort, déterminer des culpabilités. Évidemment, ceci nécessite aussi une interdiction efficace de l’utilisation des données à des fins illicites, notamment de discrimination.
Au-delà de la génomique, les autres données de santé (biométriques, métaboliques, environnementales ou issues des objets connectés) joueront un rôle essentiel dans la prévention et la médecine personnalisée. “Mon Espace Santé” constitue un premier pas important vers une maîtrise citoyenne de ces informations, en offrant un espace sécurisé et unifié où chacun peut consulter et gérer ses données médicales. Toutefois, les données stockées sur les smartphones et montres connectées, souvent beaucoup plus riches, échappent encore largement au contrôle des usagers. Il serait nécessaire d’inscrire dans la loi deux principes : (1) garantir l’exportabilité complète de toutes les données de santé générées par les appareils personnels ; (2) interdire strictement leur utilisation à des fins non médicales par les entreprises qui les collectent.
Pour tirer pleinement parti de ce potentiel, voici quelques propositions:
- Autoriser l’accès libre au séquençage génétique individuel, tout en fournissant une information claire sur la nature des résultats.
- Créer un droit au partage volontaire des données génétiques, permettant de contribuer à des projets de recherche publics ou privés dans un cadre transparent et sécurisé.
- Garantir un droit d’accès complet aux données : consultation, téléchargement, transfert ou suppression à tout moment.
- Mettre en place une infrastructure publique sécurisée pour le stockage des données biomédicales.
- Encourager la recherche sur la longévité en intégrant ces données dans des programmes nationaux de prévention et de compréhension du vieillissement.
L’Europe avance partiellement, mais malheureusement lentement, dans cette direction avec le projet EHDS (European Health Data Space), qui vise à créer un espace sécurisé permettant le partage, l’accès et la réutilisation des données de santé à l’échelle européenne. L’EHDS inclut les données génétiques et pourrait faciliter les recherches en médecine personnalisée, tout en garantissant la protection des citoyens. D’autres initiatives montrent la voie : le 100,000 Genomes Project au Royaume-Uni, l’Estonian Biobank, le FinnGen en Finlande, ou le programme américain All of Us.